 中文
中文
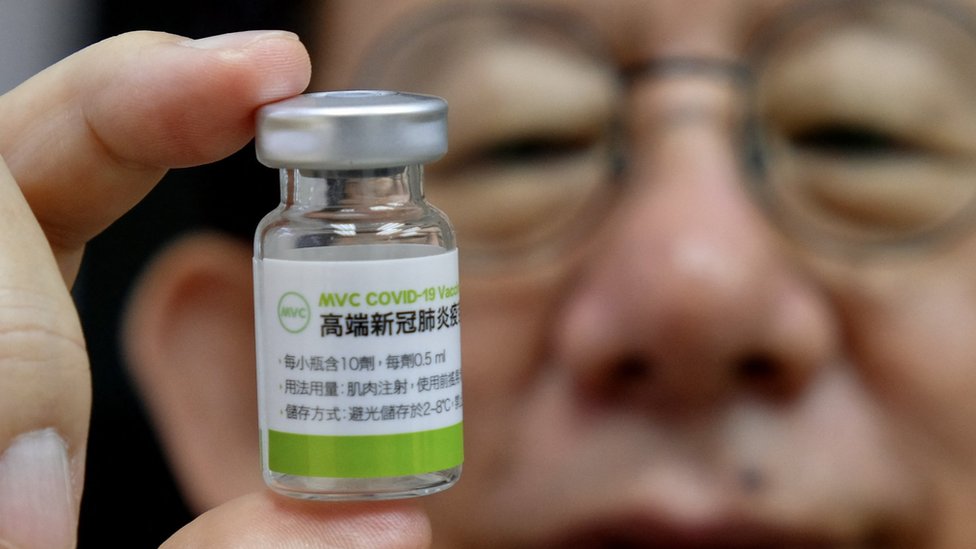
台灣周一(8月16日)開放本地自行生產的首款新冠疫苗「高端(Medigen)」的接種線上預約。
據台灣衛福部統計,至當天下午為止,約有30萬台灣民眾登記,首批將有61萬劑高端疫苗施打。
由於高端是台灣政府協助台灣藥商研發的新冠疫苗,台總統蔡英文及副總統賴清德都宣佈已上網登記預約,並在8月23日就會前往接種。
然而,高端也是全球首批先以「免疫橋接」(immuno bridging)技術取代三期實驗並通過使用地緊急授權(EUA)的新冠疫苗,在台灣醫界引起激烈辯論至今。

在新冠大流行之前,2012年在台灣成立的「高端疫苗生物製劑股份有限公司」主要從事有關腸病毒及流感疫苗等的研發及生產。
公司網站稱,高端新冠疫苗生產技術,是同美國國衛院(NIH)簽約,將基因重組S-2P棘蛋白技術移轉到台灣。該技術利用基因重組技術製作出病毒表面的棘狀蛋白,再做成疫苗打入人體,讓後者產生免疫反應,以抵抗新冠病毒。
台大醫院醫師,台灣疫苗推動協會榮譽理事長李秉穎接受台廣播節目採訪時說,高端新冠疫苗由美國國衛院提供病毒株,後者給了病毒株後每天都聯絡高端,關心研發進度。他表示,高端的新冠疫苗從研發到成品都是自己完成。
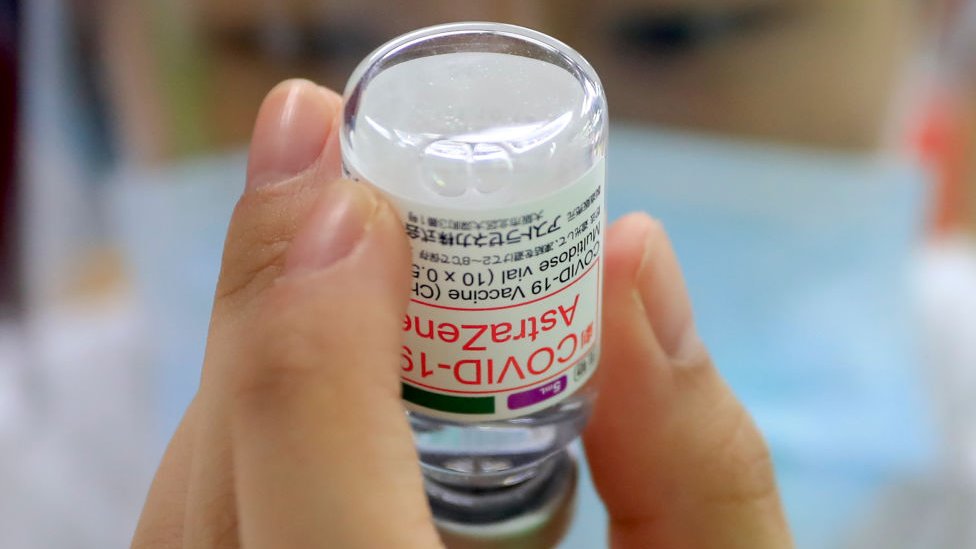
高端是全球首款先以「免疫橋接」技術取代三期實驗並通過當地緊急授權(EUA)的新冠疫苗,因此,在台灣社會也引起激烈辯論。
首先,高端在今年6月10日公布實驗結果「解盲」通過。
根據公司網站提供的資料,高端二期臨牀試驗約有4千人參加,最高齡受試者達89歲,主要結果包括兩項:一是「安全性與耐受性良好,所有受試者未出現疫苗相關嚴重不良反應」;二是「不分年齡的免疫生成性合乎預期」,數據「解盲」成功,高端因此立即向台灣政府申請EUA。
今年7月18日,台灣食藥署長吳秀梅在台指揮中心(CDC)例行記者會中公布,經專家審查會議結果通過高端疫苗申請EUA,並准許「專案製造」。
吳秀梅稱,此結果乃是鑒於高端疫苗的「中和抗體數據」已證明不劣於阿斯利康(AstraZeneca,AZ疫苗),且安全性數據顯示無重大安全疑慮。
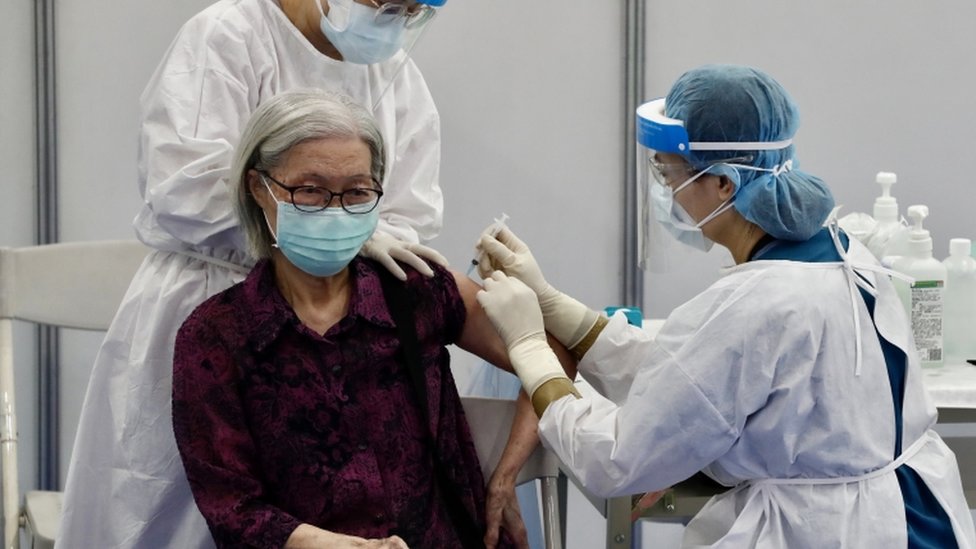
此外,台灣食藥署要求,藥商必須於專案核准製造期間,每月提供安全性監測報告,並於核准後一年內檢送國內外執行疫苗保護效益報告。
不過,台大醫院兒童醫院院長黃立民,曾向台媒康健雜誌稱,「人體試驗目前只進行到第二期,只能證明安全性沒問題,但還沒有進行三期人體試驗,保護效力不得而知,現在只能從中和抗體效價推估保護效力。」
台在野黨國民黨主席江啟臣,在今年七月高端通過EUA後,上法院控告台衛福部部長陳時中等人「圖利」。他認為,高端沒有三期臨牀試驗數據便無法知道「高端疫苗在臨牀上減少染疫、減少重症的比例,是否比得上其他主流疫苗……同樣因為欠缺三期驗證,高端到底能否有效對抗現在肆虐國際的新型變種病毒?」
前台北市長郝龍斌在8月2日召開記者會向台北高等行政法院遞狀,申請停止執行高端疫苗EUA。他說「免疫橋接」根本不是美國FDA或是歐盟藥政機關認可的技術,「全世界都沒有類似案例,若要給予高端疫苗緊急授權,應依據國際標凖,要求高端至少應提出第三期期中報告」
「免疫橋接」技術是指,在實驗室比較「中和抗體量」,取代三期實驗結果。
台灣大學公衛所教授陳秀熙向台媒康健雜誌舉例稱,「如果要報考研究所要有資格:一種是正式畢業拿到學位、一個是同等學歷,二期橋接三期就是用同等學歷去取代正式學位。」
目前美國食品藥物管理局(FDA)尚未接受以免疫橋接實驗出來的疫苗,去申請美國EUA。

第三期試驗在巴拉圭進行
根據高端公司的新聞稿,高端在今年7月20日取得巴拉圭第三期臨牀實驗的核准,開始進行第三期人體臨牀試驗,人數約1千人。
高端三期試驗仍採免疫橋接設計與AZ疫苗進行比對性試驗。並預計於今年第三季完成所有受試者試驗,並於今年第四季取得期中分析數據。
巴拉圭約有700萬人口,至今新冠確診數超過45萬人。
台衛福部長陳時中16日還透露,台灣第二款自製新冠疫苗「聯亞」,經審查後沒有通過台灣「緊急使用授權」審查,聯亞將重新提交試驗報告,並同步進行第三期臨牀,再繼續申請上市。
根據台灣中央社,自8月16日為止,台灣至少施打1劑新冠肺炎疫苗者有980萬人,人口涵蓋率約38.73%。不過,已施打2劑者僅64.9萬人,人口涵蓋率約為2.76%。
「中和抗體之幾何平均效價」是指疫苗打進人體後產生的各種抗體中,真正具有降低病毒感染率的抗體。
在台灣食藥署公布的數據稱,在高端疫苗組與AZ疫苗組原型株活病毒比較後,高端中和抗體幾何平均效價比值的95%信賴區間下限為3.4倍,大於標凖要求0.67倍,因此通過高端EUA。
不過,台中央研院院士陳哲培,則向台媒稱,高端通過EUA的研究數據在科學上「一點價值都沒有,因為抗體效價並不等於實際施打的保護力,效價數據很高,並不代表具有可靠的保護力。」
台灣疫苗研究專家、中央院生醫所何美鄉博士則稱,以中和抗體作為保護性替代指標具有法規及科學背景。她在臉書解釋,每年台灣流感疫苗更換抗原時的法規查核,都引用此方法,「其背後的必備條件是,量化抗體的實驗方法已經標凖化,且都使用國際統一的標凖試劑。所以,每一個疫苗的抗體高低是可互相比較的。」
哈佛大學流行病學博士,台大醫學院教授李建璋,在台媒天下雜誌「未來城市」專欄分析,醫界普遍認為,蛋白質疫苗(譬如高端)能刺激抗體產生,但對細胞免疫刺激效果不佳。新一代的核酸疫苗,包括AZ和莫德納(Moderna)疫苗,就是針對細胞免疫刺激所設計的疫苗,可刺激很強的細胞免疫。
長庚大學新興病毒感染研究中心主任,施信如教授向台媒HeHo(Health & Hope)雜誌說:「高端提出的中和抗體效價為662,就只是一個數值,沒辦法直接和AZ、莫德納或輝瑞在國外的實驗室做出來的中和抗體效價比較。」
李建璋則說,雖然高端二期及果證實,該疫苗在人體產生比AZ疫苗還多的抗體,但這是因為高端的蛋白質疫苗尚加了佐劑(亦即免疫刺激劑),因此能在人體內產生比AZ疫苗更多的抗體,「這是免疫學上完全可以預期的現象。若比較兩者保護力,就有一種『張飛比岳飛』的感覺,畢竟兩種疫苗的原理不同。」
目前台灣政府僅開放20歲以上的台灣居民施打高端疫苗。
李建璋認為,若擔心長者接種AZ或莫德納疫苗會無法承受較強的免疫反應(副作用),便可以選擇考慮高端。此外,他又說,如果在疫苗短缺的情況下,短期無法接種疫苗的年輕人,或需要密集出國,密集接觸人群的服務業民眾也可先考慮接種高端,「但不能排除民眾日後能加打核酸疫苗的選擇。」
本網頁內容為BBC所提供, 內容只供參考, 用戶不得複製或轉發本網頁之內容或商標或作其它用途,並且不會獲得本網頁內容或商標的知識產權。

10/04/2024 10:44AM

09/04/2024 05:00PM

09/04/2024 05:00PM